藥品上市許可制度或可解開我國仿制藥泛濫、創新藥少的尷尬困局
2015年11月4日,人大常委會授權國務院在北京、天津、河北、上海、江蘇、浙江、福建、山東、廣東、四川十個省、直轄市開展藥品上市許可持有人制度試點。11月6日,國家食藥監總局在其官網發布了《藥品上市許可持有人制度試點方案(征求意見稿)》向社會公開征求意見。
藥品上市許可持有人制度是當前國際社會普遍采用的重要制度,這個制度的核心就是鼓勵藥品研發創新,調動各方面的積極性。未來隨著該制度的實施,或可改善我國仿制藥品泛濫的現狀,促進新藥品的研發創新,也可促進資源的優化配置。
我國藥品產業現狀:仿制藥泛濫,創新原研藥少
1987年開始,我國正式實施藥品審評審批制度,新藥由國家審批,仿制藥由地方審批,造成批準文號眾多的情況。1998年國家藥品監管局成立,2001年開始批準文號清理,建立了全國統一序列(即國藥準字號)。但由于把關不嚴,一些沒有臨床價值的藥品從“地標”轉為“國標”。
目前,仿制藥占據我國制藥行業的“大半江山”。據前瞻產業研究院發布的《2015-2020年中國醫藥行業市場前瞻與投資戰略規劃分析報告》顯示,中國醫藥企業目前共擁有藥品批準文號18.7萬個,其中化學藥品批準文號12.1萬個,絕大部分為仿制藥;2014年化藥批準上市品種中,仿制藥220個,占47%;新藥127個,占27%;進口藥63個,占14%。
圖表:2014年我國化學藥品批準文號構成情況(單位:%)
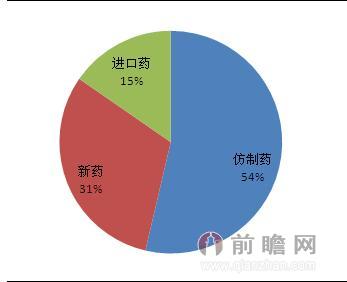
資料來源:前瞻產業研究院整理
去年,慢粒白血病患者陸勇因幫助上千名病友購買印度仿制瑞士抗癌藥“格列衛”,被湖南省沅江市檢察院以涉嫌“銷售假藥罪”提起公訴,400多名白血病患者聯名寫信,請求司法機關對陸勇免予刑事處罰。這一事件折射我國藥品產業的尷尬困局:創新原研藥少,仿制藥“品種多、藥效差、質量參差不齊”。這正是此次藥品上市許可持有人制度試點、藥品注冊分類改革致力解決的問題。
藥品上市許可持有人制度將促進藥品創新
藥品上市許可人(Marketing Authorization Holder,MAH)制度是指將上市許可與生產許可分離的管理模式。這種機制下,上市許可和生產許可相互獨立,上市許可持有人可以將產品委托給不同的生產商生產,藥品的安全性、有效性和質量可控性均由上市許可人對公眾負責。
藥品上市許可人制度的目的是鼓勵新藥創制,促進產業升級,優化資源配置,落實主體責任。以前我國藥品管理法規定,只有藥品生產企業才可以申請藥品注冊,取得藥品批準文號。MAH制度在一定程度上緩解目前“捆綁”管理模式下出現的問題,而中小型的創新型企業,包括科研院所和CRO企業,有望采取委托生產的方式,使自己成為一家只做創新研發的輕資產公司,類似海思科和Gilead的模式。
前瞻分析,實行藥品上市許可持有人制度,有利于充分調動研發者的積極性,促進藥品創新,并使批準上市的藥品可以迅速地擴大市場、占領市場。其次是有利于優化資源配置,抑制低水平重復建設,促進結構調整和產業升級。同時有利于落實企業主體責任,加強藥品質量管理,提高藥品質量,并且它有利于創新藥品治理機制,充分發揮政府、企業和市場三者在加強藥品管理中的作用。藥品上市許可持有人制度的實施或可打開我國藥品產業的尷尬困局。
| 相關推薦 |
 醫藥報告 醫藥報告
最新行業動態,解密市場盈利點,把握行業競爭主動權 詳細>> |
| 順豐等殺入醫藥物流 第三方醫藥物流市場 |
| 商務部談藥品零售轉型 醫藥電商拐點將至 |
| 醫藥醫療十三五規劃聚焦 生物醫藥產業發 |
如在招股說明書、公司年度報告中引用本篇文章數據,請聯系前瞻產業研究院,聯系電話:400-068-7188。

前瞻經濟學人
專注于中國各行業市場分析、未來發展趨勢等。掃一掃立即關注。




























