重磅!2022年中國及31省市血液制品行業政策匯總及解讀(全)政策監管日漸收緊
行業主要上市公司:目前國內生物醫藥行業的上市公司主要有天壇生物(600161)、華蘭生物(002007)、博暉創新(300318)、派林生物(000403)、衛光生物(002880)、博雅生物(300294)等。
本文核心數據:政策、規劃、目標
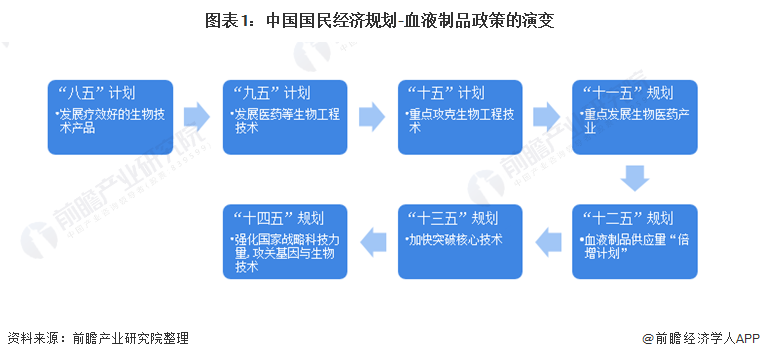
1、政策歷程圖
血液制品是我國生物醫藥制造業的重要分支,根據我國國民經濟“八五”計劃至“十四五”規劃,國家對血液制品行業的支持政策主要在于技術,經歷了從“發展”到“重點攻克”再到“十二五”期間,國內血液制品供應量“倍增計劃”,以及“強化與攻關技術”的變化。
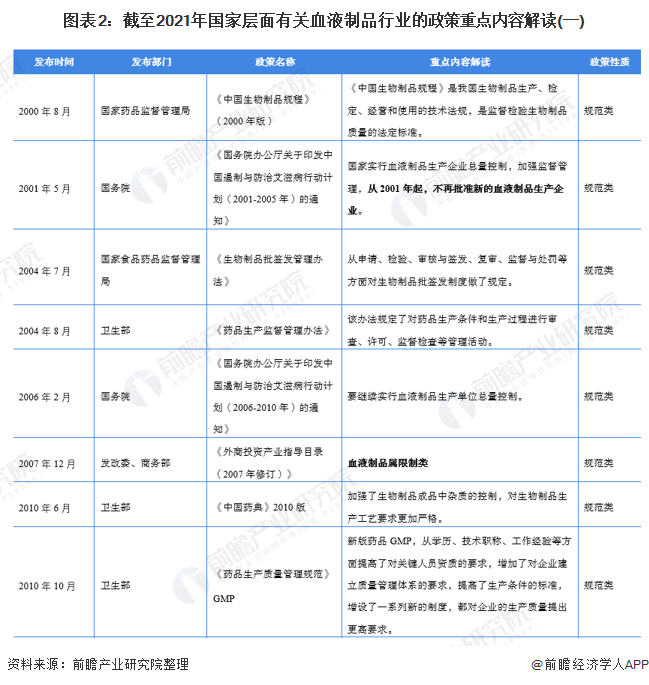
2、國家層面政策匯總及解讀
——國家層面血液制品行業政策匯總
自1996年國務院發布《血液制品管理條例》以來,血液制品行業的管控日益收緊。自2001年起,政府不再批準新企業進入血液制品行業,同時更新配套法規,大量中小型血液制品企業退出或被并購,目前僅有約30家企業仍在從事血液制品生產。嚴格的管控政策為行業內企業筑起護城河。
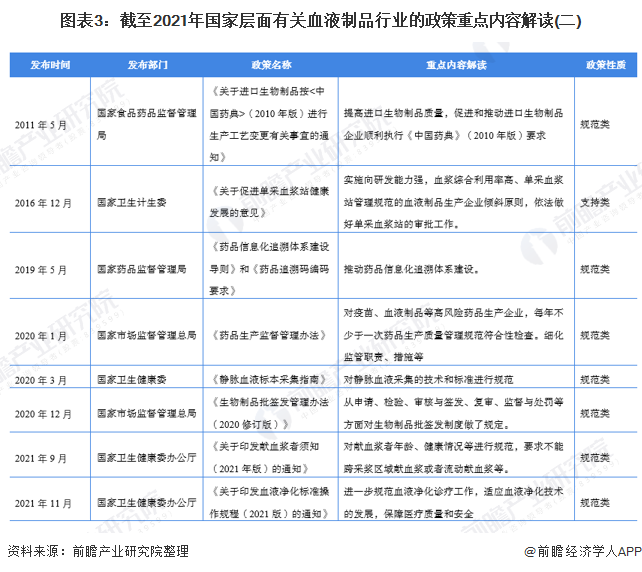
——血漿站采集政策解讀
在血漿站采集政策方面,1996年國務院發布首條《血液制品管理條例》,此后直到2006年才再度頒發《單采血漿站質量管理規范》,2008年頒布《單采血漿站管理辦法》。2020年取消了固定獻血漿者采漿年齡可延長至60周歲的規定,調整為按衛生主管部門要求執行,根據現行的《單采血漿站管理辦法》,劃定采漿區域內具有當地戶籍的18歲到55歲健康公民可以申請登記為供血漿者。

——國家層面血液制品行業管理目標解讀
目前,政府對血液制品的管控非常嚴格,以新增血漿站審批為例,2019年全年全國僅有1家單采血漿站新獲批。2020年新冠疫情導致國內采漿量下滑,在漿源有限的情況下,政策卻未見寬松,甚至日漸嚴格。
國家對疫苗類制品、血液制品、用于血液篩查的體外生物診斷試劑等生物制品,每批制品出廠銷售前或者進口時必須進行強制性審查、檢驗和批準,這也是國際通行的做法。

3、各省市層面的政策匯總及解讀
——31省市血液制品行業政策匯總
目前,中國藥品生物制品檢定所負責組織及承擔血液制品批簽發工作,北京、吉林、上海、湖北、廣東、四川、甘肅等省(市)承擔生物制品批簽發任務的藥品檢驗機構,負責受理指定區域內血液制品生產企業申請批簽發工作。
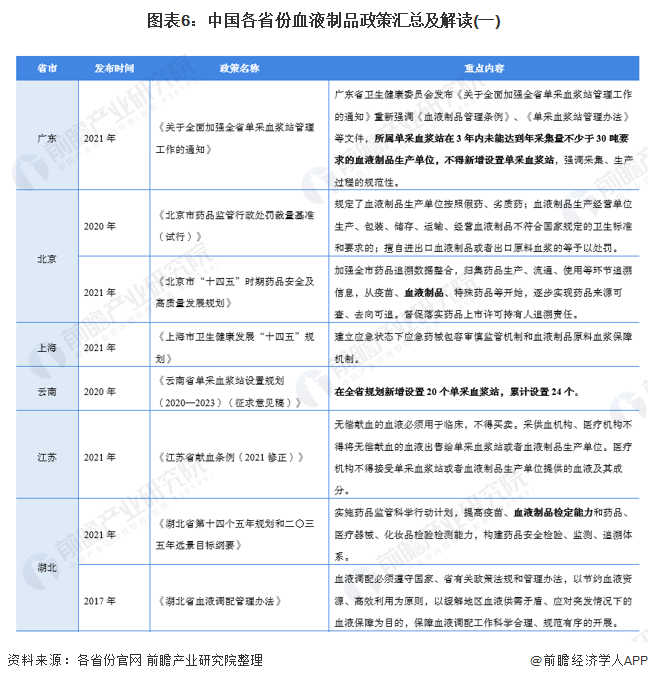

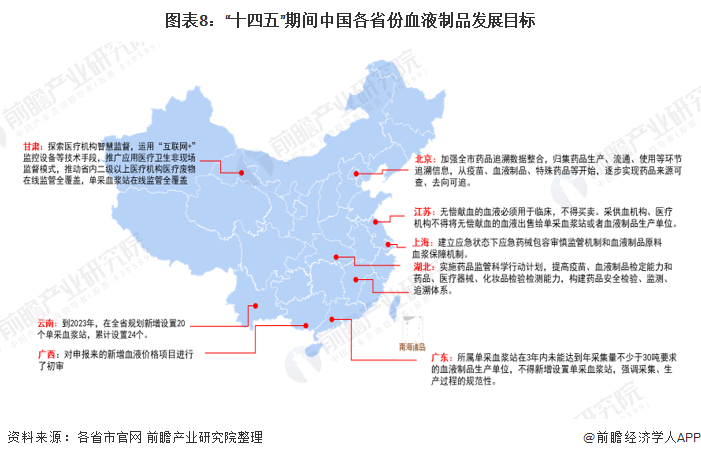
——31省市血液制品行業發展目標解讀
“十四五”期間,我國主要省份也提出了血液制品行業的發展目標。其中,云南全省提出了至2023年新增設置20個單采血漿站,累計設置24個。廣東提出2021年,所屬單采血漿站在3年內未能達到年采集量不少于30噸要求的血液制品生產單位,不得新增設置單采血漿站,強調采集、生產過程的規范性。此外,北京、甘肅等地也提出了血液制品行業相應的規范標準或規劃:
以上數據參考前瞻產業研究院《中國血液制品行業產銷需求與投資預測分析報告》,同時前瞻產業研究院還提供產業大數據、產業研究、產業鏈咨詢、產業圖譜、產業規劃、園區規劃、產業招商引資、IPO募投可研、招股說明書撰寫等解決方案。
更多深度行業分析盡在【前瞻經濟學人APP】,還可以與500+經濟學家/資深行業研究員交流互動。
前瞻產業研究院 - 深度報告 REPORTS
本報告前瞻性、適時性地對血液制品行業的發展背景、供需情況、市場規模、競爭格局等行業現狀進行分析,并結合多年來血液制品行業發展軌跡及實踐經驗,對血液制品行業未來...
如在招股說明書、公司年度報告中引用本篇文章數據,請聯系前瞻產業研究院,聯系電話:400-068-7188。

前瞻經濟學人
專注于中國各行業市場分析、未來發展趨勢等。掃一掃立即關注。





























